И для запуска канцерогенеза клеткам необходимо обладать характеристиками, отличающими их от всего остального клеточного пула.
1) Нестабильность генома и мутации.
Существуют стабильные генетические мутации, они происходят непрерывно.
При конкретно канцерогенезе происходит клона клональная экспансия предраковых клеток (триггер - случайная генетическая мутация).
В норме все механизмы репутации ДНК эффективны и все спонтанные мутации корректируются без фенотипических изменений, частота мутаций низкая.
В раковых клетках нарушена работа наблюдения (не вызывает апоптоз), накопление мутаций.
2) Сопротивление клеточной смерти.
3 основных механизма, ведущих к клеточной смерти:
- апоптоз;
- аутофагия;
- некроз;
а) Апоптоз - запрограммированная гибель клеток.
В опухолевых клетках значительно, снижает объем апоптоза (особенно в клетках опухолей высокой злокачественности или резистентных к лечению).
Механизм апоптоза.
Имеют регулирующие элементы, которые воспринимают внутренние/внешние проапоптотические сигналы и инициируют каскад протеолиза и разрушение клеток с фрагментацией ядра, конденсацией хромосом и уменьшением размера клеток с утратой межклеточного вещества; последующая фрагментация клеток и образование апоптотических телец (фагоцитируются соседними клетками);
TP53 - ген-супрессор злокачественных опухолей (регуляция апоптоза);
Хранитель генома способен индуцировать развитие апоптоза в ответ на значительное повреждение генома, например, разрушение ДНК на фоне ХТ, окислительное повреждение и УФ-излучение.
б) Аутофагия - катаболический процесс, когда клеточные компоненты разрушаются лизосомами внутри самой клетки.
Обычно вяло протекает, но активируется на стрессовые факторы окружающей среды (ХТ, ЛТ).
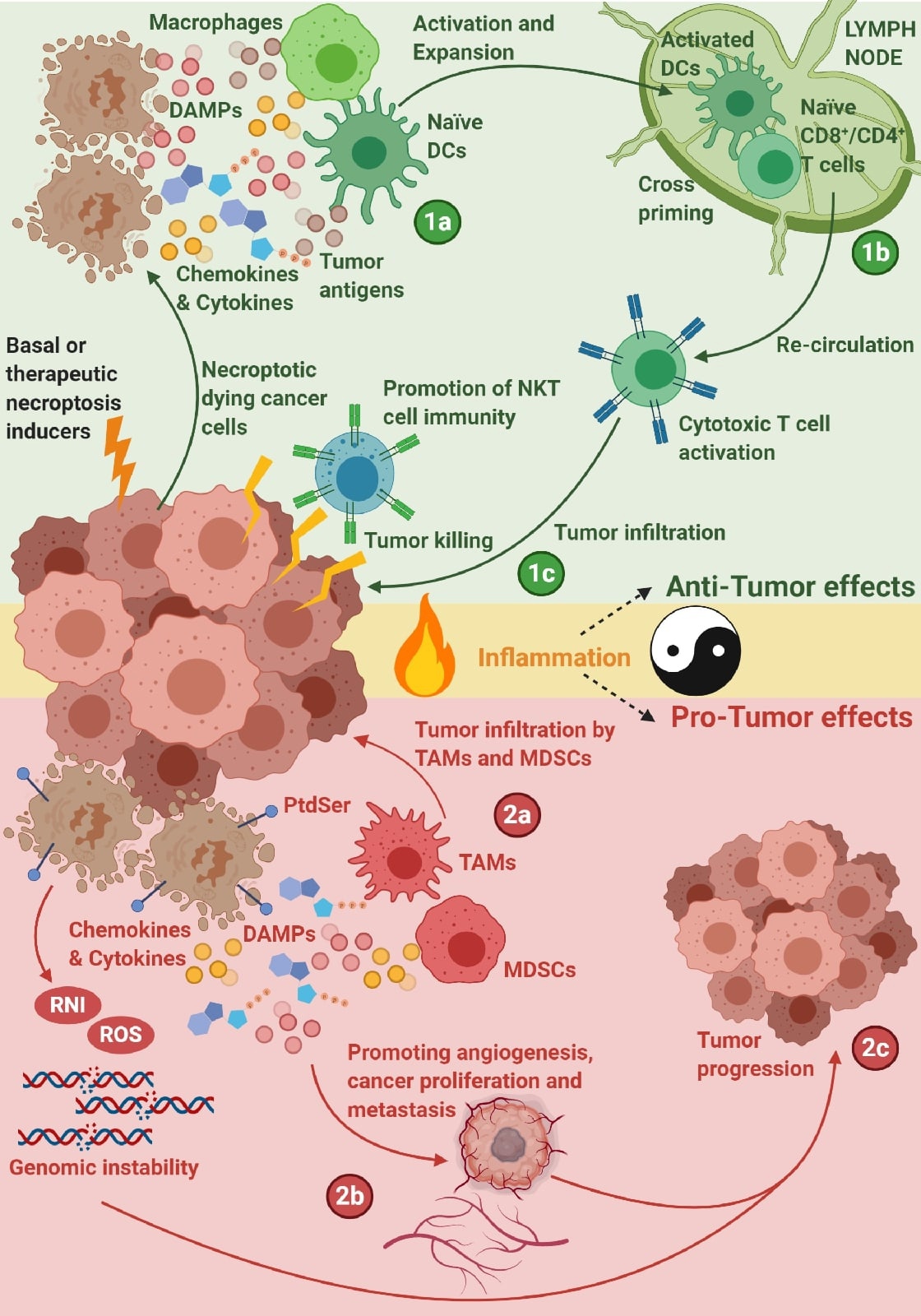
в) Некроз - преждевременная гибель клеток.
И сопровождается высвобождением клеточного содержимого в местное тканевое окружение (в отличии от апоптоза);
Некроз активирует клетки зоны воспаления, стимулирует ангиогенез и высвобождение стимулирующих факторов, увеличивается пролиферация и инвазия в тканях, усиление канцерогенеза (а не ингибирует).
3) Поддержание пролиферации
У злокачественных клеток уровень пролиферации выше, чем у обычных (обычно это связано с факторами роста, которые связываются с рецепторами и запускают тирозинкиназный внутриклеточный каскад), приводит к изменению экспрессии генов , увеличению пролиферации и роста клетки.
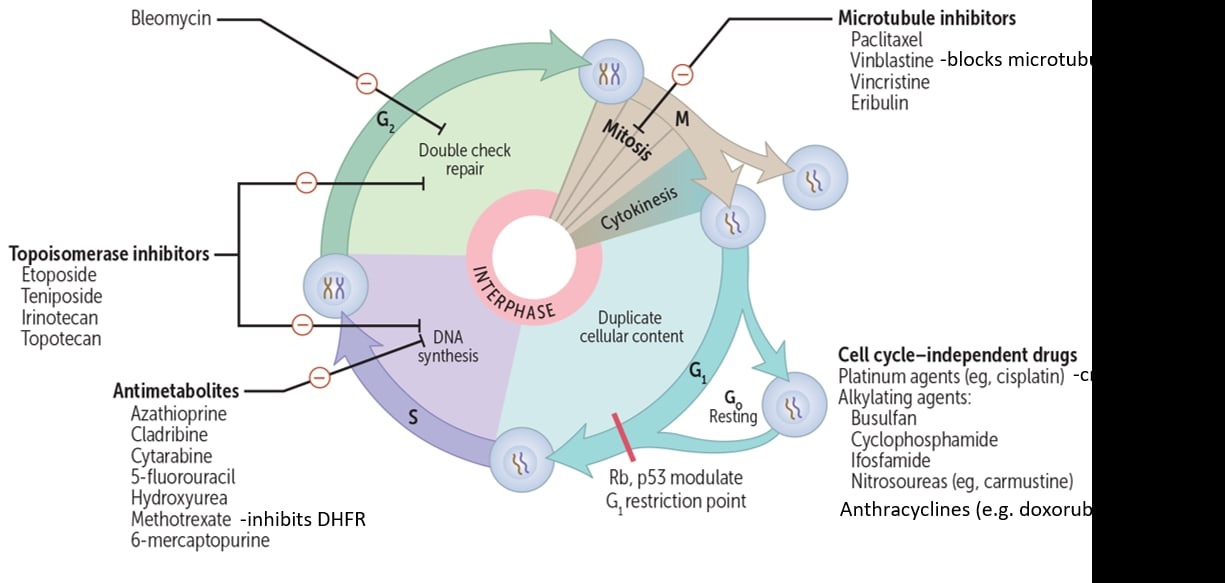
а) Клеточный цикл
4 фазы G0, G1, S, G2, M
В фазах G0 и G1 клетки чувствительны к сигналам роста. И в ответ на различные сигналы ингибирования могут останавливаться в различных точках фаз (точки приложения химиотерапевтических препаратов);
б) Стимуляция клеточного цикла
Раковые клетки синтезируют факторы роста, которые управляют своей пролиферацией (положительная обратная связь): тромбоцитарный фактор роста, трансформирующий фактор роста альфа;
Другой способ раковых клеток стимулировать пролиферацию - экспрессируют рецепторы к факторам роста, патологический рост даже в ответ на физиологическую стимуляцию.
4) Уклонение от супрессоров роста
В здоровых тканях функционирует контактный механизм торможения (межклеточный плотный контакт). У злокачественных новообразований (ЗНО) обычно нет такого механизма.
Плюс в ЗНО присутствуют мутации в ингибирующих белках, нарушение сдерживания при переходе от G к S фазе.
Также нарушение функции ТР53 (ключевой опухолевый супрессор, останавливает клеточный цикл) оказывает влияние на р21 и р27, накопление геномных дефектов;
5) Влияние теломераз (репликативное бессмертие)
ЗНО необходима способность к неограниченному делению для выживания, в этом им помогают теломеразы (основная роль в неограниченной репликации).
В нормальных клетках теломеры постепенно укорачиваются с каждым циклом репликации, препятствует бесконтрольному делению.
Теломераза - фермент, который добавляет нуклеотиды к теломерам, увеличивает число метотических делений. У злокачественных клеток этот фермент экспрессируется в значительном количестве.
6) Ангиогенез.
Постоянный рост нуждается в хорошо развитой сосудистой сети. Злокачественным клеткам также необходимы питательные вещества и кислород, избавление от метаболитов.
И ангиогенез зависит от продукции факторов роста сосудов, хорошо известна в этом плане роль сосудистого эндотелиального фактора роста и тромбоцитарного фактора роста.
Ангиогенез регулируется балансом про ангиогенных стимулов и ингибиторов (тромбоспондин-1);
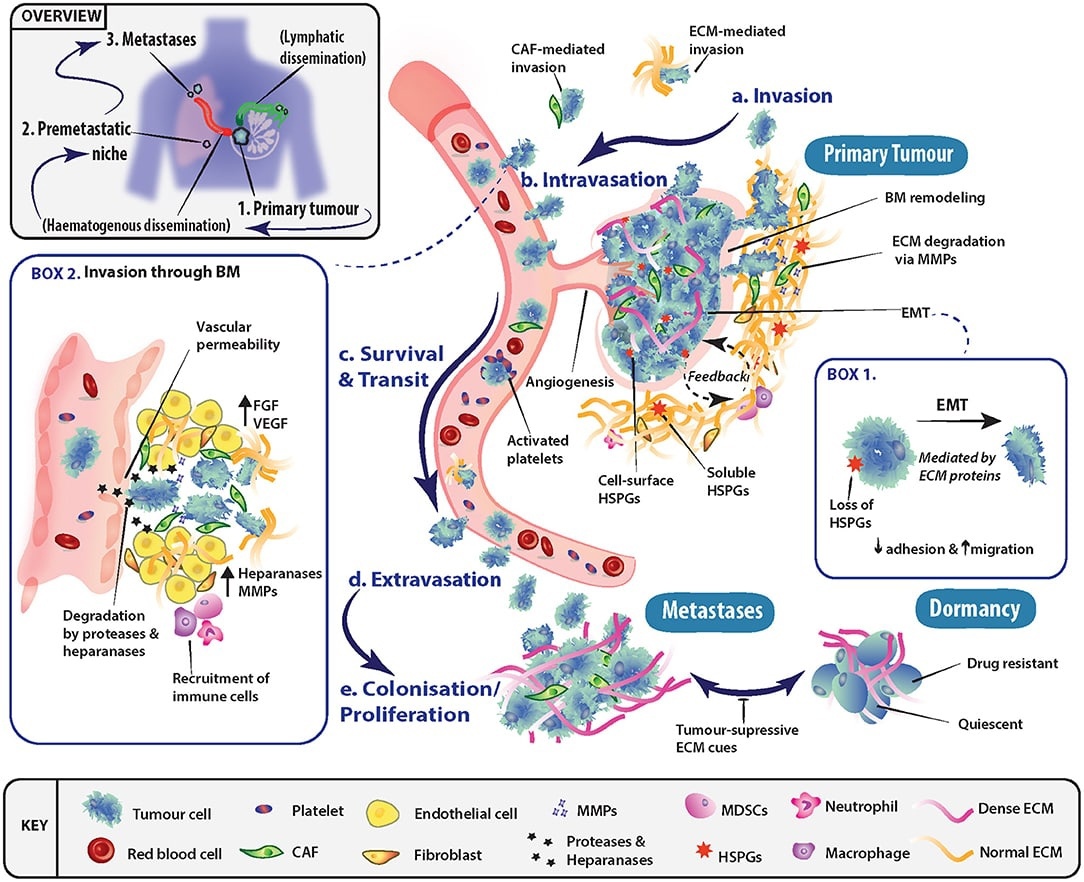
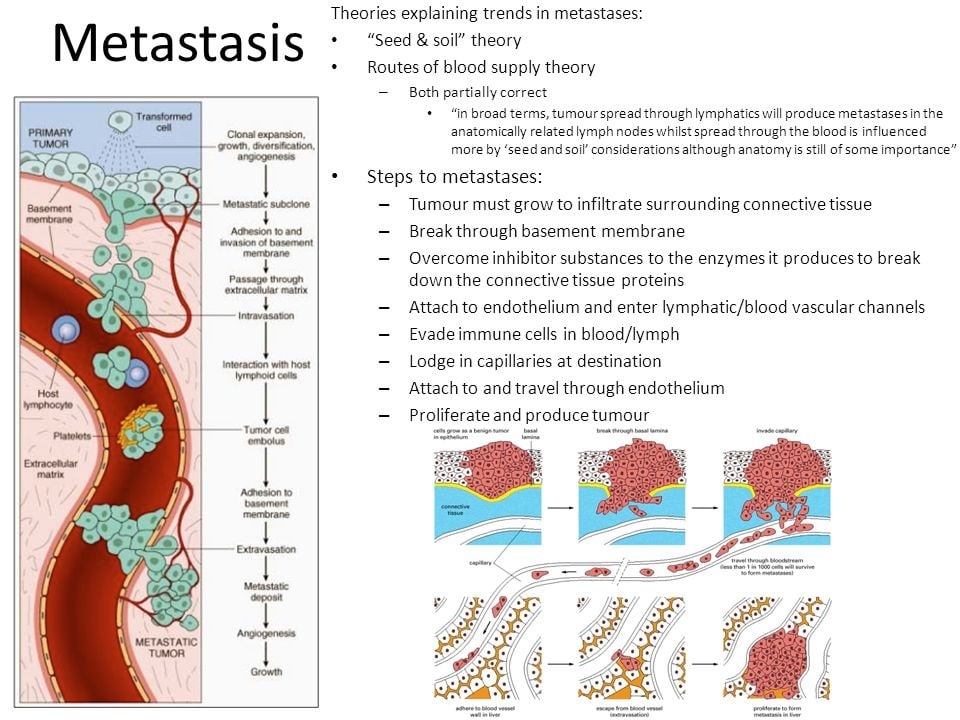
7) Инвазивный рост и метастазирование
Сложный процесс, начинающийся с тканевой инвазии, затем распространение гематогенным и лимфогенным путем, микрометастазы перерастают макрометастазы.
Перекрестное взаимодействие между злокачественными клетками и нормальными способствует инвазивному росту и метастазированию. Например, макрофаги на периферии способствуют локальной инвазии с помощью ферментов, разрушающих матрикс (металлопротеиназы и цистеиновые протеазы);
8) Стимуляция воспаления
Практически во всех опухолевых клетках обнаруживается инфильтрация иммунными клетками.
БАВ (факторы роста, проангиогенные факторы), цитокины, система комплемента - способствуют инициации и усилению воспалительного ответа;
9) Уклонение от иммунного ответа
В норме иммунная система - барьер для образования и прогрессирования опухолей. Но если есть нарушение в развитии/функционировании Т-лимфоцитов, увеличение вероятности развития рака.
Плюс раковые клетки обладают способностью "отключать" компоненты иммунной системы (рекрутирование воспалительных клеток, подавление функции цитотоксических лимфоцитов);
И в целом ЗНО развиваются и прогрессируют при нарушении их распознавания иммунной системой.